
daddy: ho dovuto “adattare” al blog questo splendido lavoro della mia trainer Flavia, purtroppo, per praticità e sintesi. L’ho fatto con dolore, ma di necessità.
E prima dell’esposizione preziosa, desidero introdurre l’argomento con una frase dei miei Nonni:
“quando i bambini dormono, crescono,” (vero),
così come durante la febbre (falso).
Tesi di Laurea in Scienze e Tecniche delle attività motorie preventive e adattive (anno 2006).
L’ormone della crescita o dell’accrescimento appartiene, insieme alla prolattina ed al lattogeno placentare alla famiglia degli ormoni somatotropi, da qui il nome di ormone somatotropo con sigla GH o STH.
E’ un ormone proteico composto da una sequenza di 191 A.A. ed è secreto dal lobo anteriore dell’ipofisi, l’adenoipofisi, situata alla base del cranio, nel cervello, e secerne i suoi ormoni sotto il diretto controllo dell’ipotalamo attraverso mediatori polipeptidici rilasciati da neuroni ipotalamici che raggiungono l’ipofisi anteriore attraverso il sistema portale (organo situato
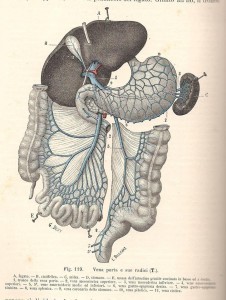
tra due reti di capillari venosi, come il fegato) ipotalamo-adenoipofisario ad azione stimolatoria, detti fattori di rilascio ipotalamici, il GHRH (Growth Hormone Releasing Hormone), ed inibitori, la Somatostatina (SS o GHR-IH, Growth Hormone Inhibiting Hormone); questi determinano una secrezione pulsatile di tale ormone in seguito all’alternarsi di prevalenza stimolatoria del GHRH e di prevalenza inibitoria della SS.
Quando la SS è più alta ed impedisce la secrezione di GH, il GHRH induce sintesi dell’ormone, prodotto e liberato nella fase in cui la SS scende per effetto feedback.
I picchi maggiori si hanno durante il sonno, in particolare con il suo inizio(1): si dice che “i bambini crescono durante il sonno”.
Tali picchi si riducono con l’età, al punto che la secrezione di GH nell’età media è circa il 15% di quella puberale(2). Oltre il sonno, altri stimoli alla secrezione del GH sono rappresentati da esercizio fisico, traumi, sepsi e stato nutrizionale deficitario.
Il GH agisce su specifici recettori cellulari inducendo lipolisi(3), sintesi ossea e proteica, antagonizzando l’azione insulinica.
E’ stato mostrato che il GH aumenta la massa magra, riduce il grasso, rafforza il sistema immunitario e le funzioni sessuali. Inoltre, è in grado di determinare ritenzione di sodio, potassio e acqua.
La crescita corporea è il ruolo generalmente riconosciuto a tale ormone ma, da un punto di vista biochimico, esso influenza anche il metabolismo di proteine, carboidrati e lipidi; stimola inoltre la proliferazione dei condrociti, nonché la sintesi di RNA e DNA.
Molti degli effetti metabolici e di crescita sono mediati da un ormone peptidico, l’IGF-I (o somatomedina c)(4), una sostanza prodotta principalmente dal fegato che regola tra l’altro gli effetti sull’accrescimento delle cartilagini epifisarie, zone di accrescimento dell’osso.
Il gene che codifica per l’ormone della crescita umano è localizzato sul braccio lungo del cromosoma 17, che contiene altri 4 geni correlati: 3 diverse varianti del lattogeno placentare e una variante del GH espressa nel sinciziotrofoblasto (somatotropina corionica).
Il gene del GH determina la produzione di RNA-messaggeri che dirigono la sintesi del pre-ormone dal quale, successivamente viene rimosso un peptide-segnale per generare la forma finale dell’ormone. Il GH secreto è una miscela eterogenea di peptidi.

Regolazione della secrezione dell’ormone della crescita.
Il GH, il più abbondante ormone adeno-ipofisario, è sintetizzato e secreto dalle cellule somatotrope, concentrate particolarmente nelle sue parti laterali.
La secrezione giornaliera di GH varia durante la vita; è alta nei bambini, raggiunge i più alti livelli durante l’adolescenza, per poi diminuire durante la vita adulta in relazione all’età: essa si verifica in picchi isolati, con una periodicità di circa 3 ore, ma irregolari.
Tra un picco ed il successivo, il GH circolante si abbassa fino a livelli non rilevabili dai metodi di dosaggio attualmente in uso. L’ampiezza dei picchi di secrezione è massima durante la notte e la secrezione maggiore si osserva immediatamente dopo l’insorgenza del sonno profondo.
La SS, sintetizzata da neuroni più ampiamente distribuiti e da cellule neuro-endocrine site nel tratto gastrointestinale e nel pancreas, inibisce la secrezione dell’ormone della crescita.
Si conoscono ulteriori secretagoghi del GH, peptidici e non, in grado di stimolare la secrezione del GH attraverso un recettore accoppiato a proteine G diverso dal recettore del GHRH: diversi neurotrasmettitori (dopamina ed acetilcolina), farmaci (insulina, GHRH, agonisti α-adrenergici, antagonisti β-adrenergici, GABAergici e dopaminergici), metaboliti, aminoacidi e stimoli diversi sono in grado di influenzare la secrezione del GH, modulando il rilascio di GHRH e/o di SS.
La dopamina, la serotonina (5-idrossitriptamina) e gli agonisti α₂-adrenergici stimolano il rilascio di GH, mentre gli insulino-simili come l’IGF-, nonché lo stesso GH, inibiscono tale rilascio.
Uno stato di ipoglicemia stimola la secrezione dell’ormone della crescita, così come l’esercizio fisico, uno stato di stress, di eccitazione emotiva, le perdite ematiche, la febbre, i traumi e l’ingestione di cibi ricchi di proteine, in particolare quelli contenenti l’aminoacido arginina.
La sensibilità al GH è più alta nelle donne che negli uomini ed è massima nel periodo immediatamente precedente l’ovulazione; inoltre, sono state osservate concentrazioni sieriche di GH più elevate nelle donne in pre-menopausa rispetto a quelle in post-menopausa(5). Questa differenza può essere spiegata dall’effetto stimolante che gli estrogeni esercitano sulla secrezione di GH.
Gli obesi mostrano una riduzione reversibile delle risposte del GH a tutti gli stimoli, compreso il GHRH stesso(6).
Basi molecolari e cellulari dell’azione dell’ormone della crescita
Tutti gli effetti dell’ormone della crescita derivano dalla sua capacità di interagire con il recettore specifico per il GH, il GHR, una proteina transmembranaria a singola catena di circa 625 aminoacidi: Questo recettore di membrana, ampiamente distribuito, appartiene alla superfamiglia dei recettori delle citochine e presenta somiglianze strutturali con il recettore per la prolattina, con il recettore per l’eritropoietina e con molti recettori per le interleuchine(7).
Sebbene il GH agisca direttamente sugli adipociti per aumentare la lipolisi e sugli epatociti per incrementare la gluconeogenesi, i suoi effetti anabolici e promotori della crescita sono mediati indirettamente dall’induzione dei fattori di crescita insulino-simile (IGFs).
Ci sono due membri principali della famiglia IGF: IGF-1 e IGF-2.
L’IGF-1 o somatomedina, è un polipeptide a singola catena di 70 aminoacidi , dipende dal GH in modo più stretto ed è un fattore più potente nel periodo post-natale, per cui l’IGF-1 sembra essere il principale mediatore dell’azione del GH. La maggior parte di tale molecola circolante è sintetizzata nel fegato, anche se l’IGF-1 prodotto localmente in molti tessuti (ad es. l’IGF-1m del tessuto muscolare) può anche esercitare effetti paracrini o autocrini sulla crescita cellulare. Le concentrazioni di IGF-1 dipendono dal GH e da altri fattori(8).
L’IGF-1 libero ha probabilmente maggiore importanza fisiologica e clinica rispetto all’IGF-1 totale; infatti, solo l’IGF-1 non legato, che è solo lo 0.5-1% del totale, è capace di reagire con il suo recettore specifico.
Le concentrazioni totali di IGF-1 tendono a decrescere con l’età, ma non è stato osservato un declino della frazione libera(9).
Dopo la sua sintesi ed il suo rilascio, l’IGF-1 interagisce con recettori posti sulla superficie cellulare attraverso i quali attua la sua attività biologica. Il recettore per l’IGF di tipo 1 è molto simile al recettore per l’insulina; è costituito da un eterotetramero con attività tirosin-chinasica intrinseca. Questo recettore è presente essenzialmente in ogni tessuto, e lega sia l’IGF-1 che l’IGF-2 con elevata affinità; anche l’insulina può attivare il recettore di tipo 1 per l’IGF, ma con una affinità che è di circa 100 volte minore di quella degli IGF.
Il GH e l’IGF-1 rivestono una notevole importanza anche nel normale sviluppo del sistema immunitario; infatti, entrambe le molecole vengono prodotte dai monociti/macrofagi e l’IGF-1 stimola la funzione dei neutrofili. Gli si riconoscono altri effetti metabolici diretti, come l’attività lipolitica, e tale azione sembra diretta al tessuto adiposo(10), ma sono stati messi in dubbio i suoi effetti sulla riduzione dell’adipe; si riconosce che il GH possieda un effetto di ripartizionamento sui depositi adiposi che comporta una riduzione del grasso sottocutaneo. In effetti, un’ analisi del 2003 ha determinato che il GH è praticamente inutile per la cura dell’obesità(11).
Esercizio fisico e GH: come l’esercizio fisico modifica la secrezione di GH.
L’esercizio fisico rappresenta un potente stimolo per la secrezione del GH, sia nell’uomo che nell’animale da esperimento(12). La risposta del GH è, infatti, un aspetto non secondario degli adattamenti fisiologici dell’organismo all’esercizio fisico stesso. A tale riguardo, bisogna considerare le fondamentali funzioni metaboliche svolte da questo ormone, distinguibili in:
azione “anabolica” di stimolo sulla sintesi proteica, che si traduce in uno stimolo alla crescita corporea;
azione sul metabolismo glucidico con stimolo alla gluconeogenesi epatica, alla conseguente ipoglicemia e inibizione dell’utilizzazione di glucosio a livello muscolare;
azione sul metabolismo lipidico con aumento dei livelli circolanti di acidi grassi liberi (FFA) e corpi chetonici, nonché della loro utilizzazione e ossidazione a livello tissutale(13).
Studi hanno dimostrato che l’utilizzo di rhGH abbinato ad esercizio fisico, l’esercizio con integrazione salina e l’uso del GH da solo aumentano la massa corporea magra (LBM), tuttavia, la forza muscolare aumentava solo attraverso l’esercizio(14).
Nell’uomo, il picco della risposta del GH all’esercizio fisico viene osservato dalla maggior parte degli Autori tra il 25° ed il 60° minuto nel corso degli esercizi di lunga durata, o tra la fine del 5°-15° minuto del periodo di recupero nel caso di esercizi di durata inferiore a 20 minuti. Sembra che la maggiore risposta del GH si osservi negli esercizi con maggiore richiesta della glicolisi anaerobica di tipo lattacido. La risposta del GH all’esercizio è maggiore nei soggetti sedentari che negli atleti, così come è maggiore nel giovane rispetto all’anziano.
Vari studi indicano che la risposta del GH a determinati carichi di lavoro è inversamente correlata al grado di allenamento; ciò è stato attribuito ad un aumento del tono somatostatinico ipotizzabile nel soggetto allenato rispetto al sedentario per l’attivazione dell’asse CRH-IPOFISI. Inoltre, l’ormone tiroideo T3 (triiodotirosina) ed il cortisolo determinano, sinergicamente, un aumento della sintesi di GH. Tutto ciò risulta ben chiarito dal ruolo centrale svolto dallo stress e dal metabolismo anaerobico nella risposta del GH, infatti la soglia anaerobica, in virtù del processo adattativo indotto dall’allenamento, si situa progressivamente a intensità maggiori di “stress”.
Il GH è il maggiore mediatore dell’espressione genica dell’IGF-1.
In ogni modo, la riduzione delle concentrazioni sieriche dell’IGF-1 è anche regolata da vari fattori, oltre che dal livello di GH. Il grado di prestazione fisica può essere una determinante potenziale dei livelli di IGF-1.
Studi indicano che l’allenamento di resistenza negli uomini di mezza età ha aumentato l’attività del sistema GH/IGF-1 ed ha migliorato la glucoregolazione sia a riposo che durante l’esercizio ad alta intensità(15).
Studi condotti da Borer hanno dimostrato che, in risposta all’esercizio fisico, si osservano maggiori concentrazioni di GH circolante, con un aumento di ampiezza e frequenza dei picchi spontanei di secrezione rispetto ai controlli sedentari. Tale situazione si traduce in uno stimolo alla crescita somatica attraverso una variazione del rapporto massa grassa/massa magra, con un decremento del contenuto di grasso corporeo totale.
Come il GH può essere utile nell’esercizio fisico. 
Le motivazioni che spingono gli atleti a scegliere l’rhGH come sostanza dopante sono:
facile ed illimitata disponibilità, grazie alle tecniche di sintesi con DNA ricombinante;
relativa sicurezza (non esistono in letteratura veri danni a breve termine da doping da GH, escluse le complicanze a lungo termine della cosiddetta “sindrome acromegalica-simile”);

difficoltà nell’identificazione di tale ormone nelle urine con le metodiche antidoping attualmente in uso;

facile somministrazione (per via i.m. o s.c.).
Gli effetti collaterali acuti legati all’assunzione di rhGH sono minimi e rappresentati soprattutto da ritenzione idrica ed artromialgie, mentre gli effetti avversi più pericolosi nel tempo compresi nella “sindrome acromegalica-simile” comprendono ipertensione arteriosa sistemica, cardiomegalia con cardiomiopatia ischemica, malattie coronariche, visceromegalia con aumentata incidenza di processi flogistici e neoplastici, miopatie, neuropatie periferiche, dislipidemie ed intolleranza al glucosio con elevato rischio diabetogeno.
Tuttavia, l’uso di rhGH dà effetti evidenti sulla massa muscolare e sulla riduzione della massa grassa; la massa magra aumenterebbe del 9% senza esercizio fisico, mentre quella grassa diminuirebbe del 15%. Inoltre, l’assunzione di rGH determina un > della massa ossea, della crescita dei capelli, della cicatrizzazione delle ferite, della funzione immunitaria, sessuale e mnesica(16).
Nel 1989, Salomon dimostrò nei soggetti adulti affetti da GHD che la terapia sostitutiva con rGH determina una significativa modificazione della composizione corporea, con un incremento di circa 5 Kg di massa magra soprattutto a livello degli arti ed una parallela > di 5 Kg di tessuto adiposo, soprattutto a carico del distretto intra-addominale in cui il grasso tende ad accumularsi nelle situazioni di deficit di GH. A seguito di tale modificazione della composizione, sono state dimostrate negli adulti con GHD un significativo ripristino della forza muscolare ed un miglioramento nelle prestazioni sportive(17).
E’ possibile che anche l’IGF-1 giochi un ruolo nei cambiamenti adattativi all’allenamento: perciò le concentrazioni ematiche ed urinarie di tali molecole possono essere correlate al grado di allenamento. Sedute intense di esercizio ed allenamento possono aumentare il trasporto attivo di glucosio nel muscolo, stimolato dall’IGF-1(19).
Il sistema GH/IGF ha funzioni fisiologiche e biochimiche influenzanti la prestazione, sia in gara che durante l’allenamento(20). Inoltre, le azioni di GH/IGF-1 influenzano sia il metabolismo energetico che quello proteico, oltre alla composizione corporea(21).
A causa dell’alto rischio legale, della difficoltosa reperibilità e dei pericolosi effetti avversi legati in particolare all’uso continuato del GH, spesso si preferisce utilizzare aminoacidi e integratori proteici, al fine di stimolare maggiormente la produzione endogena di tale ormone. Esistono studi dimostranti come aminoacidi quali l’arginina, l’ornitina, la lisina e la glutammina incrementano i livelli del GH quando introdotti per via endovenosa od orale, ma negli atleti non è raccomandabile(22). Un altro studio del lontano 1981, non riportato, ha dimostrato che la somministrazione di BCAA (aminoacidi a catena ramificata) come leucina, isoleucina e valina, in specifici dosaggi e combinazioni, ha stimolato la secrezione di GH.
GH ed invecchiamento
L’attività dell’asse GH/IGF-1 subisce variazioni pronunciate durante la durata della vita umana. La secrezione pulsatile spontanea del GH è transitoriamente elevata alla nascita, ma poi decresce a livelli costanti fino all’inizio della pubertà. E’ massima nel periodo peri-puberale, particolarmente in termini di ampiezza della pulsazione(23), e si ha maggiormente durante la notte, in particolare nel corso delle fasi 3 e 4 del sonno (onda lenta del sonno profondo), quando si ha circa il 60 – 70% di rilascio di GH.
Iniziando nella giovane-media età adulta, la produzione di GH è stimata decrescere ad un ritmo di circa il 14% per decade; è più alta nelle donne, tanto che non c’è una significativa differenza nei livelli di GH correlata al genere negli individui anziani(24).
Le persone anziane ed i giovani adulti con GHD hanno il sonno delta ridotto. E’ stato recentemente dimostrato che il ritmo di sonno profondo con onda lenta decresce di circa l’80% dalla 1° (16-25 anni) alla media (30-50 anni) età adulta, con una concomitante riduzione del 75% della secrezione spontanea del GH(25).
I livelli totali di IGF-1 continuano a ridursi progressivamente con l’età, a dispetto della mancanza di un’ulteriore < della funzione somatotropa. Comunque, è stato riportato che le risposte dell’IGF-1 e dell’ IGFBP-3 ad una dose molto bassa di GH negli anziani sono conservate(26).
Considerati insieme, questi dati suggeriscono che la sensibilità periferica del GH non è pregiudicata dall’avanzare dell’età. In ogni modo, i livelli di IGF-1 non sono sempre ridotti nei soggetti anziani. La prevalenza delle concentrazioni sieriche di IGF-1 al di sotto del range trovato in uomini e donne tra i 20 ed i 29 anni è stata riportata essere dell’11% nella 4° decade di vita, del 20% nella 5°, del 22% nella 6°, del 42% nella 7° e del 55% nell’8° e nella 9°(27). In accordo con questo studio, è stato rilevato che, in circa il 50% di oltre 100 soggetti anziani sani, i livelli di IGF- 1 sono ancora simili a quelli registrati nei giovani adulti(28). D’altra parte, i bassi livelli circolanti di IGF-1 nell’altro 50% degli anziani non sono causati solo dalla danneggiata secrezione somatotropa, ma riflettono anche il declino dei livelli degli steroidi sessuali gonadici, qualche carenza nutrizionale di proteine e micronutrienti, nonché cambiamenti nello stile di vita, ad esempio inerenti l’attività fisica(29). Inoltre, a tutte le età, il livello sierico di IGF-1 è stato trovato essere inversamente correlato con l’adiposità (noto dal 1981).
Età e controllo neuroendocrino della secrezione di GH
Sono state chiaramente mostrate le variazioni età-correlate nel controllo neurormonale e neurotrasmettitoriale sulla secrezione somatotropa, indicando che un ipotalamo in invecchiamento gioca un ruolo importante nella riduzione del rilascio di GH(30).
Età e determinanti metabolici dell’attività dell’asse GH/IGF-1
Oltre alle alterazioni del controllo neuroendocrino della secrezione del GH, molti altri fattori ormonali e metabolici influenzano il declino età-correlato dell’attività dell’asse somatotropo. L’adiposità e gli steroidi gonadici sono tra i fattori periferici che influenzano le variazioni età-correlate della secrezione del GH(31). La secrezione giornaliera del GH è negativamente correlata all’Indice di Massa Corporea (BMI) ed alla percentuale di grasso corporeo, i quali aumentano con l’età, anche se questa e la massa corporea agiscono indipendentemente sulla funzione somatotropa(32).
Il rimpiazzo di estrogeni aumenta la pulsatilità del GH nelle donne in post-menopausa ed è stata descritta una significativa relazione positiva tra i livelli endogeni di estradiolo ed il rilascio spontaneo di GH in uomini anziani sani(33).
La somministrazione di androgeni aumenta la secrezione di GH nei ragazzi peri-puberi e negli uomini con ipogonadismo ipo- ed iper-gonadotropo(34), probabilmente per un’azione diretta piuttosto che per un’aromatizzazione a estrogeni(35).
I fattori metabolici principali coinvolti nell’aumento dell’adiposità età-correlato, che ipoteticamente può influenzare la secrezione del GH nell’invecchiamento, sono gli acidi grassi liberi (FFA) e l’insulina. Vari studi hanno mostrato che l’azione insulinica peggiora con l’età: è possibile che ciò dipenda dall’accumulo di grasso corporeo addominale.
Attività dell’asse GH/IGF-1 e composizione corporea nell’invecchiamento
Nella senescenza si ha una riduzione della forza muscolare, a causa dell’invecchiamento delle fibre muscolari e delle loro innervazioni, a causa di uno stile di vita più sedentario e della riduzione dell’attività fisica. Parte del processo dell’invecchiamento che colpisce la composizione corporea sembra essere correlata ai cambiamenti nel sistema endocrino(36), i quali includono le alterazioni nella sensibilità all’insulina e nella funzione tiroidea, la menopausa nelle donne e l’andropausa negli uomini, i ridotti livelli circolanti di deidroepiandrosterone (DHEA) e della sua forma solfatata (DHEAS), ed un declino dell’asse GH/IGF-1. In particolare, quest’ultimo contribuisce, nella vecchiaia, ai cambiamenti età-correlati della composizione corporea, delle funzioni, per esempio del sistema cardiovascolare e del metabolismo, i quali sono simili a quelli osservati nei pazienti con GHD(37).
La risposta del GH al GHRH negli anziani è > da vari substrati e pienamente ripristinata dall’arginina, la quale probabilmente agisce attraverso l’inibizione del tono somatostatinico ipotalamico(38). La capacità dell’arginina di ripristinare la responsività somatotropa al GHRH negli individui anziani mostra che il pool di rilascio del GH è fondamentalmente preservato nella pituitaria in invecchiamento, e suggerisce l’esistenza dell’iperattività somatostatinica(38). Quest’ultima potrebbe dipendere dall’ipoattività colinergica ipotalamica che è stata descritta con l’invecchiamento. D’altro canto, si è visto che due neuropeptidi, la galanina e la met-encefalina, sono capaci di aumentare, ma non di ripristinare, la responsività del GH al GHRH nei soggetti anziani, benché sia stato riscontrato un incremento nel contenuto di galanina nel cervello in senescenza(39).
Come nella deficienza di GH (GHD), il normale invecchiamento è associato a decrementi nella sintesi proteica e nella percentuale di massa corporea magra ed ossea, nonché ad incrementi nella percentuale del grasso corporeo(40). La massa corporea magra diminuisce dai 25 ai 70 anni di età, approssimativamente di 12 kg (27%) negli uomini e di 5 kg (15%) nelle donne(41). Ciò può riflettere i processi atrofici nel muscolo scheletrico, fegato, rene, milza, pelle ed osso.
Il grasso corporeo totale aumenta dai 18 agli 85 anni di età, approssimativamente del 18% negli uomini e del 12% nelle donne. L’assunzione calorica ed il dispendio energetico declinano con l’età e le persone anziane tendono a pesare circa il 25% in più rispetto ai giovani adulti(42).
GHD nell’adulto
L’adulto con deficit di GH (GHD) è caratterizzato da decrementi a livello osseo, muscolare e della massa corporea magra di circa il 9%, e da un aumento dell’adiposità(43), oltre alla riduzione dell’acqua extracellulare. La massa muscolare scheletrica e ventricolare sinistra è diminuita, così come la capacità di esercizio aerobico(44).
Dopo 3 anni di GH, è stato riscontrato un aumento della forza muscolare, ma è rimasta solo del 66% rispetto a quella dei soggetti normali(45). Inoltre, la supplementazione discontinua di GH nei pazienti con GHD porta ad una riduzione della forza muscolare isometrica e nella sezione muscolare del 5% dopo un anno. I pazienti GHD presentano anche una relativa insulino-resistenza, con ridotta tolleranza al glucosio, ed hanno profili lipidici aterogenici, con relativa ipertrigliceridemia ed elevato colesterolo LDL risultanti in morbilità e mortalità più alte, se comparate a soggetti sani (46).
Test di stimolo
Per valutare la secrezione di GH, si ricorre a due tipi di test di stimolo: fisiologici e farmacologici. Test di stimolo fisiologico del GH con esercizio fisico – sonno ed il test di stimolo farmacologico: di tolleranza all’insulina, test alla L-arginina, al GHRH.
Il problema della valutazione della secrezione del GH utilizzando i test di stimolo è data dalla scarsa riproducibilità e dall’elevata percentuale di risposte falsamente negative. In caso di sospetto GHD, il test di stimolo più accreditato in termini di accuratezza e di precisione diagnostica sembra essere quello dell’ipoglicemia insulinica il quale, se dà valori di GH < 3ng/ml, ne permette la diagnosi; alternativamente, viene spesso utilizzato il test GHRH + arginina, il quale fa fare diagnosi di GHD quando < 9 ng/ml. A questo test, solitamente, fa seguito un incremento significativo del GH, per cui è utilizzato efficacemente(47).
Un difetto secretorio di GH potrebbe rappresentare una componente patogenetica di alcuni processi involutivi che caratterizzano la senescenza e di alcune modificazioni metaboliche, immunologiche e funzionali. Nel corso dell’invecchiamento si evidenzia una riduzione dei recettori colinergici del SNC; è stata inoltre documentata una selettiva compromissione dell’attività neuronale colinergica nei pazienti con demenza senile, oltre a precedenti ricerche attestanti il ruolo di primaria importanza del sistema colinergico nella neuroregolazione secretoria del GH(48).
L’arginina verosimilmente libera GH tramite l’inibizione della somatostatina ipotalamica. Nell’uomo anziano l’arginina, è in grado di potenziare la risposta del GH al GHRH, al pari di quanto osservato nel soggetto giovane adulto, suggerendo che l’iposecrezione di GH nella senescenza è secondaria ad una alterazione ipotalamica(49).
Vari fattori fisiologici alterano la secrezione pulsatile del GH, inclusi l’età, la razza, la composizione corporea, la localizzazione del grasso (in particolare il grasso viscerale addominale), il sonno, la nutrizione, l’esercizio e le concentrazioni sieriche degli steroidi gonadici, dell’insulina e dell’IGF-1(50).
Gli steroidi gonadici femminili, chiamati estrogeni (o estradiolo), hanno un’influenza positiva importante sulla secrezione del GH, giocando un ruolo maggiore nell’amplificazione secretoria del GH durante la pubertà. Indipendentemente dal grado di allenamento, le donne hanno un livello basale di GH plasmatici più elevato rispetto agli uomini; questa differenza scompare se si paragonano soggetti allenati(51). Negli adulti, c’è una forte relazione positiva tra i livelli di estradiolo e la secrezione di GH, tant’è che sia la secrezione spontanea che quella stimolata del GH sono più alte nelle donne rispetto agli uomini.
L’insulina in sé è capace di inibire direttamente la sintesi ed il rilascio di GH dalle cellule somatotrope, così come di ridurre la risposta del GH alla crisi ipoglicemica nei soggetti normali(52).
Età, GH e performance fisica.
L’età umana è associata ad un declino dell’attività dell’asse GH/IGF-1 ed a vari cambiamenti nella composizione corporea, nella funzione e nel metabolismo, i quali mostrano strette similitudini con quelli dei giovani adulti con deficit patologico di GH (GHD). I cambiamenti età-correlati nell’attività dell’asse GH/IGF-1 sono principalmente dipendenti dalle variazioni età-correlate del controllo ipotalamico della funzione somatotropa, la quale è anche affetta da cambiamenti degli ormoni periferici e dell’input metabolico. Il termine somatopausa indica la potenziale connessione tra il declino età-correlato nei livelli di GH e IGF-1 ed i cambiamenti nella composizione corporea, nelle funzioni strutturali e nel metabolismo che caratterizzano l’età. L’esercizio fisico è un importante regolatore ambientale dell’attività dell’asse GH/IGF-1.
L’aumento del livello fisico e l’allenamento regolare aumentano la produzione di GH negli adulti, mentre la risposta del GH all’esercizio aerobico o di resistenza è ridotta con l’età. Nei soggetti anziani, l’esercizio regolare ha la potenzialità di migliorare la forma fisica globale e la qualità della vita, ed è anche associato a ridotta morbilità e ad aumentata longevità. Effetti positivi si sono notati seguendo una terapia con GH negli adulti deficitari. Questa ipotesi ha condotto ad esperimenti (trials) clinici focalizzati sull’rhGH e/o sull’rhIGF-1 quali interventi farmacologici anabolici nei soggetti anziani.
Per ripristinare l’attività dell’asse GH/IGF-1 con scopi anabolici, anti-età, l’attenzione è stata anche posta sulle molecole rilascianti GH come il GHRH, i secretagoghi sintetici del GH oralmente attivi (GHS) e, più recentemente, al GHS endogeno naturale, la ghrelina, la quale esercita varie azioni biologiche importanti, inclusi la regolazione del bilancio metabolico e gli effetti orexigenici. Al momento, comunque, non c’è un’evidenza definitiva che i “fragili” soggetti anziani possano trarre reali benefici dal ripristino dei livelli di GH ed IGF-1 entro i valori (range) dei giovani adulti attraverso il trattamento con GH, IGF-1, GHRH o GHS. L’alterazione dell’attività dell’asse GH/IGF-1 durante l’età è rivista prendendo in considerazione il ruolo dell’attività fisica quale regolatore della funzione dell’asse e considerando gli effetti del ripristino dei livelli circolanti di GH e IGF-1 sulla composizione corporea e sulla performance fisica.
L’esercizio fisico gioca un ruolo importante nella regolazione dell’attività dell’asse GH/IGF-1, in quanto incrementa i livelli di GH, benché la risposta del GH all’esercizio dipenda dalla durata e dall’intensità della sessione di allenamento, dai livelli di allenamento del soggetto all’esercizio e da altri fattori ambientali(53).
L’aumentato livello prestativo e l’allenamento regolare aumentano la produzione di GH negli adulti, mentre la risposta del GH all’esercizio aerobico o di resistenza è ridotta con l’età.
Risposte all’esercizio acuto
I livelli di GH aumentano in risposta all’esercizio acuto, con un livello-soglia approssimativo del 30% di VO₂max (percentuale della massima captazione di ossigeno). L’estensione di questo incremento è soggetto ad una varietà di influenze. Inizia entro 10 minuti dall’inizio dell’esercizio e dipende da tipo ed intensità di questo, con un incremento dei livelli che arriva fino a 100 volte, particolarmente in risposta all’esercizio anaerobico e all’ipossia. Oltre alla sua stimolazione acuta, l’esercizio quotidiano è stato anche relazionato alla secrezione notturna del GH; a tale riguardo, con l’esercizio prolungato, > 4h., aumenta la porzione del GH secreto nella II° fase del sonno, mentre altri studi non hanno riportato alcun effetto, se non un’attenuazione del rilascio notturno di GH.
In base ai differenti risultati riportati, l’effetto dell’allenamento sulla risposta del GH all’esercizio acuto è incerto. Conformemente al suo rilascio basale, la risposta del GH all’esercizio è più pronunciata nei ragazzi di età puberale rispetto a quelli prepuberi(54) ed essendo un semplice e sicuro stimolo al rilascio di GH, ne è stato studiato l’impiego come test clinico di screening per il deficit di GH.
I meccanismi responsabili dell’aumento del GH esercizio-indotto rimangono controversi. Negli uomini sani non allenati, la risposta del GH all’esercizio di elevata intensità è aumentata dall’antagonista narcotico naloxone(55), mentre negli atleti sembra avere un effetto opposto, attenuando la risposta del GH: queste differenze probabilmente suggeriscono alterazioni nell’omeostasi neuroendocrina indotte dall’esercizio cronico.
Anche le vie colinergiche centrali sembrano essere coinvolte nella risposta del GH, essendo aumentate dalla piridostigmina (anticolinergico indiretto). Anche i segnali metabolici periferici influenzano la risposta del GH all’esercizio, essendo aumentata dall’ingestione dei grassi ma attenuata da quella dei carboidrati(56).
Risposte all’esercizio cronico. 
Qualunque sia l’effetto esatto dell’esercizio acuto, c’è l’evidente incremento indiziario dei livelli di IGF-1 in circolo, sia in risposta all’allenamento cronico contro resistenza (allenamento con i pesi 2-3 volte a settimana) che all’allenamento di durata, ed è proporzionale al VO₂max ed all’attività fisica(57). Questa risposta avviene entro 2 settimane di allenamento, tanto che i livelli basali aumentano fino al 37%.
Esercizio fisico e asse GH/IGH-1
L’esercizio fisico è un importante regolatore ambientale dell’attività dell’asse GH/IGF-1.
Fu mostrato per la prima volta da Roth nel ’63 che l’esercizio incrementa i livelli circolanti di GH. Questa osservazione fu tra le prime risposte endocrine all’esercizio identificate e questo effetto è stato utilizzato clinicamente per esaminare il rilascio del GH, particolarmente nei bambini(58).
La risposta del GH all’esercizio è dipendente dalla durata e dalla intensità della sessione di allenamento, dal livello di preparazione dei soggetti in allenamento e da altri fattori ambientali(59). E’ comunque dimostrato che il carico e la frequenza dell’esercizio giocano un ruolo importante nella regolazione delle concentrazioni plasmatiche del GH.
Benché gli esatti meccanismi coinvolti nella risposta del GH esercizio-indotta rimangano incerti, è stato proposto un certo numero di candidati. Questi includono fattori neuroendocrini, la stimolazione diretta delle catecolamine, del lattato e/o dell’ossido nitrico ed i cambiamenti dell’equilibrio acido-base(59). Nei giovani di sesso maschile, l’esercizio regolare e non quello acuto, è associato ad una più alta produzione di GH e ad una maggiore stimolazione del rilascio di GH dal GHRH(60). E’ stato ipotizzato che ciò dipenda dalla ridotta attività somatostatinergica ipotalamica e da una maggiore pulsatilità del GH(61). L’incremento nei livelli di performance fisica e l’allenamento regolare aumentano la produzione di GH nei giovani adulti, negli sciatori d’alta quota, nei corridori di corsa campestre ed in quelli di lunga distanza(62).
Incrementi acuti di GH conseguenti ad esercizi pesanti contro resistenza, suggeriscono che lo stimolo maggiore all’ipertrofia ed ai miglioramenti nella forza e nella potenza muscolari avvenga attraverso la produzione locale di IGF-1, ad esempio nel muscolo scheletrico(63).
Performance fisica e asse GH/IGF-1 nell’invecchiamento
La risposta acuta del GH all’esercizio aerobico o contro resistenza è ridotta con l’età(13).
Similmente alle persone più giovani, gli uomini e le donne anziani hanno incrementi nella forza muscolare e nella massa corporea magra come risposta all’allenamento pesante, nonostante manchino incrementi nelle concentrazioni basali o nei modelli secretori endogeni del GH. Pertanto, il ruolo del GH endogeno durante l’esercizio ed il contributo della somministrazione di GH esogeno all’incremento nell’anabolismo proteico muscolare e nella massima forza muscolare volontaria durante l’allenamento possono essere minimi(64).
L’esercizio regolare negli anziani ha la potenzialità di migliorare complessivamente la performance fisica e la qualità della vita ed è anche associato ad una maggiore sensibilità all’insulina, a ridotti profili lipidici aterogenici e ad aumentata massa corporea magra(65).
I benefici fisiologici e funzionali dell’incremento dell’attività muscolare sono stati riscontrati anche fino alla nona decade di vita, per di più è risaputo che l’esercizio regolare è associato a ridotta morbilità e ad aumentata longevità(66).
I declini nella produzione di GH, IGF-1 e nella massa muscolare, e l’incremento nell’adiposità che si hanno nei soggetti anziani sani hanno condotto ai tentativi di capire se la somministrazione di GH dia benefici a tali persone. La somministrazione di GH da 3 a 6 mesi a soggetti anziani sani ha aumentato i livelli di IGF-1 rispetto a quelli osservati negli individui più giovani di controllo, mentre sono significativamente aumentati la massa muscolare, lo spessore cutaneo ed il contenuto minerale osseo, e si è ridotta la massa grassa(67). La capacità funzionale, invece, non è aumentata e sono stati riscontrati frequenti effetti collaterali(68).
Studi hanno mostrato che la somministrazione di GH con o senza gli steroidi sessuali in anziani sani, femmine e maschi, aumenta la massa corporea magra e riduce la massa grassa(69). Comunque, la somministrazione combinata di steroidi sessuali e di GH fa aumentare marginalmente la forza muscolare e la VO₂max negli uomini, mentre le donne non hanno cambiamenti significativi né nella forza, né nella resistenza cardiovascolare.
Certamente i meccanismi attraverso i quali il GH agisce sulla performance fisica sono molto più complessi del semplice incremento della massa corporea magra; per esempio, il GH stimola l’eritropoiesi in varie situazioni(70) ed esercita significativi effetti cardiovascolari, incrementando il volume plasmatico, il flusso sanguigno periferico, il volume del battito ventricolare sinistro ed il rendimento cardiaco(71). Tutti questi fattori possono ben contribuire all’> della capacità aerobica, ma si è visto chiaramente che la sola terapia con GH, in assenza di una qualche forma di programma di allenamento, può incrementare la massa corporea magra ma non la sua capacità funzionale.
Poiché la somministrazione di rhGH causa una ritenzione di liquidi ed un incremento del contenuto totale corporeo di acqua, si è ipotizzato che gran parte del guadagno riscontrato nella massa corporea magra con il trattamento con rhGH negli anziani possa essere semplice ritenzione idrica, la quale confonde le misurazioni della composizione corporea. Oltre alla ritenzione, sono stati riportati altri frequenti effetti collaterali dati dalla somministrazione di rhGH, come l’aumentata incidenza alla compressione del tunnel carpale, a mialgia ed artralgia. Un ulteriore effetto collaterale ma transitorio è l’aumento del glucosio ematico e delle concentrazioni di insulina(20). Nel loro complesso, questi effetti limitano l’utilità della terapia sostitutiva con rhGH nelle persone anziane(64).
Considerazioni
L’attività dell’asse GH/IGF-1 subisce un declino età-correlato che, come il deficit patologico giovanile di GH (GHD), è associato a cambiamenti sfavorevoli nella composizione corporea, come la riduzione della massa muscolare e di quella ossea, nonché l’aumento della massa grassa; tali modificazioni sono correlate a stanchezza muscolare, osteoporosi, dislipidemie, obesità, diabete mellito e disturbi cardiovascolari. Sono stati fatti vari tentativi allo scopo di ripristinare i livelli di GH e di IGF-1 entro i range dei giovani adulti. Benché il ruolo stimolante dell’esercizio fisico sull’attività dell’asse GH/IGF-1 sia ridotto con l’età, l’esercizio regolare ha la potenzialità di migliorare la performance globale e la qualità della vita nelle persone anziane, ed è anche associato a maggiore sensibilità insulinica, ridotto profilo lipidico aterogenico, aumentata massa corporea magra, ridotta morbilità ed aumentata longevità.
Ad ogni modo, sono necessarie ulteriori ricerche per stabilire dei programmi di esercizio dedicati per differenti sottogruppi di persone anziane e per dimostrare definitivamente se i “fragili” anziani possano realmente beneficiare del trattamento con rhGH, rhIGF-1 o con secretagoghi del GH. m
Il risultato della mia ricerca conferma ciò che maggiormente interessava: la secrezione di GH aumenta dopo esercizio fisico e, affinché ciò si realizzi, è necessario uno stimolo adeguato in termini di intensità, compatibilmente ai livelli basali. Seppure il campione sia numericamente limitato, nei maschi si verifica un innalzamento del GH esercizio-indotto maggiore rispetto a quello che si osserva nelle femmine. Tuttavia, tali dati mostrano anche che i valori basali di GH nelle femmine sono maggiori di quelli riscontrati nei maschi, conformemente a quanto riportato in letteratura(34), pertanto nelle femmine è forse necessario fornire uno stress maggiore in termini di intensità dell’esercizio. Non sono state riscontrate correlazioni tra i valori di GH e quelli degli ormoni tiroidei.
Cconclusioni
Gli studi più recentemente svolti sul GH dimostrano che questo ormone, denominato somatotropo per indicare la sua principale azione promuovente la crescita, ha anche un effetto ipoglicemizzante e lipolitico. Gli effetti metabolici ed anabolici sembra che siano determinati dal suo principale mediatore periferico, l’IGF-1 (o somatomedina-c), soprattutto dal tipo tessuto-specifico (ad esempio l’IGF-1m nel caso del muscolo scheletrico, recentemente isolato in tale tessuto), rispetto all’IGF-1 epatico. Ciò è dimostrato dal fatto che i valori di IGF-1 risultano più elevati negli atleti e che aumentano in maniera direttamente proporzionale ai livelli della VO2max.
Sia il GH che l’IGF-1 potenziano le funzioni immunitarie e mnesiche, oltre a quelle rigenerative tisssutali ed osteo-articolari. Infatti, a causa degli innumerevoli vantaggi metabolici indotti dall’asse GH/IGF-1 –sinteticamente rappresentati dall’ottimizzazione del rapporto massa magra/massa grassa, a favore della prima ed a svantaggio della seconda, si è sviluppato l’enorme interesse “di massa” sugli allettanti effetti del GH sull’organismo.
Ciò ha determinato l’espansione di tutto il mercato lecito o non basato sull’rhGH, sull’rhIGF-1 e analoghi, ma anche sui secretagoghi (GHS), sugli oligopeptidi GHRPs, sui neuropeptidi, sugli aminoacidi tra i quali spicca l’arginina.
Eppure sembra che tali sostanze non siano certamente prive di effetti collaterali; questi, se non raggiungono la portata nociva di quelli relativi all’rhGH (in particolare a livello cardiovascolare ed osteoarticolare), potrebbero comunque presentarsi a livello renale ed epatico per quel che concerne gli aminoacidi, sulla base di un loro eccessivo consumo cronico estrinsecato da iperuricemia ed iperazotemia. Inoltre, non va dimenticato che i “magici” effetti indotti dall’rhGH e dall’rhIGF-1 sull’> della massa magra sono dubbi, se non confondibili con la ritenzione idrica, e comunque non sono accompagnati dai relativi aumenti di forza o di resistenza muscolare. Anche gli effetti lipolitici dell’rhGH sono incerti. Pare che tale sostanza abbia più che altro un effetto di ripartizionamento del grasso corporeo (riducendo quello sottocutaneo ed aumentando quello viscerale). È stato inoltre recentemente dimostrato che il suo utilizzo è praticamente inutile contro l’obesità.
Per arginare le problematiche concernenti gli effetti collaterali, secondari all’uso cronico di tali sostanze esogene, oggi l’attenzione si è posta sul GHS endogeno, la ghrelina, sulla quale sono attualmente in corso varie sperimentazioni. Nondimeno, è stato da tempo dimostrato da vari studi che l’esercizio fisico è un potente stimolatore ambientale dell’asse GH/IGF-1.
L’esercizio intenso aumenta gli oppioidi endogeni i quali riducono il tono somatostatinico che risulta più elevato negli atleti per l’iperattività dell’asse CRH-IPOFISI, per cui l’incremento del GH esercizio-indotto risulta più prolungato o più pronunciato nei sedentari, come confermato da questa sperimentazione.
Comunque l’unica strada sana e sicura da percorrere è quella dell’esercizio fisico regolare.
Fonte Bibliografica:
1) Jamieson J. ET cOLL. Growth hormone: Reversing human aging naturally. Safe Goods, East Canaan, Connect., 1997.
2) Hagberg J. M. et Coll. Metabolic Responses in young and older athletes and sedentary men. J. Appl. Physiol., 1988, 65:900-908.
3) Gertner J. M. Effect of growth hormone on body fat in adults. Horm. Res., 1993, 40:10-15.
4) Le Roith D., Insulin-like growth factors. New Eng. J. Med., 1997, 336(9):633-40.
5) Van den Berg G. et Coll. An amplitude-specific divergence in the pulsatile mode of GH secretion underlies the gender difference in mean GH concentrations in men and pre-menopausal women. J. Clin. Endocrinol. Metab., 1996, 81(7):2460-7.
6) Arant I. et Coll. Response of fat cells to growth hormone (GH) : effect of long term treatment with recombinant human GH in GH-deficient adults. J. Clin. Endocrinol. Metab., 1994, 78:1392-1395.
7) Finidori J. et Coll. A dominant-negative mutation of the growth hormone receptor. Nat. Genet., 1997, 16:13-14.
8 ) Blum W. F. et Coll. Serum level of insulin-like growth factor I (IGF-I) and IGF secretion. J. Clin. Endocrinol. Metab., 1993, 76:1610-30.
9) Lambert J.A.M. et Coll. Serum free IGF-1, total IGF-1, IGFBP-1 and IGFBP-3 levels in an elderly population: relation to age and sex steroid levels. Hormon To Rinsko, Clin. Endocrinol. (Oxf.), 1998, 48:471-8.
10) Samra J. S. et Coll. Suppression of the nocturnal rise in GH reduces subsequent lipolysis in subacutaneous adipose tissue. Eur. J. Clin. Invest. 1999, 29:1045-52.
11) Shadid S. et al., Effects of growth hormone administration in human obesity. Obesity Res., 2003, 11:170-75.
12) Kanaley J. et Coll. Cortisol and GH responses to exercise at different times of the day. J. Clin. Endocrinol. Metab. 86, 2001, 6:2881-2889.
13) Aroson D. et Coll. Exercise stimulates the mitogen-activated protein kinase patway in human skeletal muscle. J. Clin. Invest., 1997, 6:1251-1257.
14) Roelen C. A. et Coll. Plasma insulin-like factor-I and high affinity GH-binding protein levels increase after 2 weeks of strenous physical training. Int. J. Sports Med., 1997, 18:238-41.
15) Manetta J. et Coll. Concentrations…d’exploration et les anomalies metaboliques et musculaires. Service Central de Physiologie Clinique, Montpellier, Francia, 1995.
16) Yarasheski K. E. et Coll. Effect of GH and resistance exercise on muscle growth in young men. Am. J. Physiol. V.25, 1992.
17) Cuneo R. et Coll. GH treatment in GH deficient adults I. Effect on muscle mass and strength J. Appl. Phy., 1991, 70:688-694.
19) Hokama J. K. et Coll. Voluntary exercise training enhances glucose transport in muscle stimulated by insulin-like growth factor. I. J. Appl. Physiol., 1997, 82:508-12.
20) Jenkins P. J. GH and exercise, Clin. Endocrinol., 1999, 50:683-9.
21) Rodriguez-Arnao J. et Coll. Effects of GH replacement on physical performance and body composition in GH deficient adults. Clin. Endocrinol., 1999, 51:53-60.
22) Chromiak J. A., Antoni J. Nutrition, 2002 Jul-Aug, 18(7-8):683-4.
23) Chatelain P. et Coll. Fetal and neonatal somatotroph function. Front. Pediatr. Neuroendocrinol., 1994, 20: 127-30.
24) Ghigo E. et Coll. Human ageing and the GH/IGF-1 axis. J. Pediatr. Endocrinol. Metab., 1996, 9: 271-8.
25) Steiger A., Sleep and Endocrinology. J. Int. Med., 2003, 254: 13-22.
26) Lissett C. A., Chalet S. M., The insulin-like growth factor-I generation test: peripheral responsiveness to growth hormone is not decreased with ageing. Clin. Endocrinol. (Oxf.), 2003, 58: 238-45.
27) Ghigo E. et Coll. Neural control of GH secretion in aged humans. In: Muller E. E., Cocchi D., Locatelli V eds., Growth hormone and somatomedins during lifespan. Berlin: Sprinter Verlag, 1993, 275-87.
28) Janssen J. A. et Coll. Serum free IGF-I, total IGF-I, IGFBP-1 and IGFBP-3 levels in an elderly population: relation to age and sex steroids levels. Clin. Endocrinol. (Oxf.), 1998, 48: 471-8.
29) Waters D. L. et Coll. Serum sex hormones, IGF-1 and IGFBP3 exert a sexually dimorphic effect on lean body mass in aging. J. Gerontol. A Biol. Sci. Med. Sci., 2003, 58: 648-52.
30) Muller E. E. et Coll. GH-related and extra-endocrine actions of GH secretagogues in aging. Neurobiol. Aging, 2002, 23: 907-19.
31) Weltman A. et Coll. Impact of abdominal visceral fat, GH, fitness, and insulin on lipids and lipoproteins in older adults. Metabolism, 2003, 52: 73-80.
32) Iranmanesh A. et Coll. Age and relative adiposity are specific negative determinants of the frequency and amplitude of GH secretory burst and half-life of endogenous GH in healthy men. J. Clin. Endocrinol. Metab., 1991, 73: 1081-8.
33) Ghigo E. et Coll. Human ageing and the GH/IGF-1 axis. J. Pediatr. Endocrinol. Metab., 1996, 9: 271-8.
34) Veldhuis J. D., Bowers C. Y. Three-peptide control of pulsatile and entropic feedback-sensitive modes of GH secretion: modulation by estrogen and aromatizable androgen. J. Pediatr. Endocrinol. Metab., 2003, 16: 587-605.
35) Dieguez C. et Coll. Regulation of somatotroph cell function by the adipose tissue. Int. J. Obes. Relat. Metab. Disord., 2000, 24: 100-3.
36) Bryhni B. et Coll. Age or waist as determinant of insulin action? Metabolism, 2003, 52: 850-7.
37) Lamberts S. W. J. et Coll. The endocrinology of ageing. Science, 1997, 278: 419-24.
38) Khan A. S. et Coll. GH, insilin-like growth factor-1 and the aging cardiovascular system. Cardiovasc. Res., 2002, 54: 25-35.
39) Gil-Ad I. et Coll. Effects of ageing on human plasma GH response to clonidine. Mech. Ageing Dev., 1984, 27: 97-100.
40) Rudman D. et Coll. Endocrinology and metabolism in the elderly. Oxford: Blackwell Scientific, 1992, 50-68.
41) van Cauter E. et Coll. Differential rates of ageing of slow wave sleep and REM sleep in normal men: impact on GH and cortisol levels. J. Am. Med. Assoc., 2000, 284: 861-8.
42) Poehlman E. T. et Coll. Regulation of energy expenditure in aging humans. Annu. Rev. Nutr., 1990, 10: 255-75.
43) Giustina A. et Coll. Pathophysiology of the neuroregulation of the GH secretion in experimental animals and the humans. Endocr. Rev., 1998, 19:717-97.
44) Hurel S. J. et Coll. Relationship of physical exercise and ageing to GH production. Clin. Endocrinol. (Oxf.), 1999, 51: 687-91.
45) Jorgensen J. O. et Coll. Three years of GH treatment in GH- deficient adults: near normalization of body composition and physical performance. Europ. Journ. of Endocrinol., 1994, 130: 224-228.
46) Webster J. M. et Coll. The effect of GH replacement therapy for up to 12 months on lipoprotein composition and lipoprotein (a) in growth hormone-deficient adults. Atherosclerosis, 1997, 133: 115-21.
47) Pellecchia M.T. et Coll. GH response to arginine test distinguishes multiple system atrophy from PD. Clin. Endocrinol. (Oxf.), 2005 Apr; 62 (4): 428-33.
48) Ghigo E. et Coll., A neuroendocrinological approach to evidence an impairment of central cholinergic function in aging. J. Endocrinol. Invest., 1992, 15: 665-670.
49) Ghigo E. et Coll. GH secretion in Alzheimer’s disease: studies with GH-releasing hormone alone and combined with pyridostigmine or arginine. Dementia, 1993, 4: 315-320.
50) Weltman A. et Coll. Neuroendocrine control of GH release during acute aerobic exercise. J. Endocrinol. Invest., 2003 Sep; 26 (9): 843-50.
51) Bunt J. C. et Coll. Sex and training differences in human GH levels during prolonged exercise. J. Appl. Physiol., 1986, 61: 1796.
52) Vermeulen A. Ageing, hormones, body composition, metabolic effects. World J. Urol., 2002, 20: 23-7.
53) Eliakim A. et Coll. Fitness and the GH-insulin-like growth factor-I axis in adolescent males. Med. Sci. Sports Exerc., 1998, 30: 512-7.
54) Bouix O. et Coll. Plasma beta-endorphin, corticotrophin and GH responses to exercise in pubertal and prepubertal children. Horm. Metab. Res., 1994, 26: 195-9.
55) Grossman A. et Coll. The role of opioid peptides in the hormonal responses to acute exercise in man. Clin. Science, 1984, 67: 483-91.
56) Tsintzas O. K. et Coll. Influence of carbohydrate supplementation early in exercise on endurance running capacity. Med. Sci. in Sports & Exerc., 1996, 28: 1373-9.
57) Horber F. F. et Coll. Effect of regular physical training on age-associated alteration of body composition in men. Eur. Journ. of Clin. Invest., 1996, 26: 279-85.
58) Cumming D. C., Hormones and athletic performance. In: Felig P., Baxter J. D., Frohman L. A. eds. Endocrinol. Metab. 3^ ed., New York: Mc Graw-Hill, 1995, 1837-85.
59) Godfrey R. J. et Coll. The exercise-induced GH response in athletes. Sports Med., 2003, 33: 599-613.
60) Kanaley J. A. et Coll. Human GH response to repeated bouts of aerobic exercise. J. Appl. Physiol., 1997, 83: 1756-61.
61) Eliakim A. et Coll. Fitness and the GH-insulin-like growth factor-I axis in adolescent males. Med. Sci. Sports Exerc., 1998, 30: 512-7.
62) Hurel S. J. et Coll. Relationship of physical exercise and ageing to GH production. Clin. Endocrinol. (Oxf.), 1999, 51: 687-91.
63) Harridge S. D. R. Ageing and local growth factors in muscle. Scand. J. Med. Sci. Sports, 2003, 13: 34-9.
64) Zachwieja J. J. et Coll. Does GH therapy in conjunction with resistance exercise increase muscle force production and muscle mass in men and women aged 60 years or older? Phys. Ther., 1999, 79: 76-82.
65) Deschenes M. R. et Coll. Performance and physiologic adaptations to resistance training. Am. J. Phys. Med. Rehabil., 2002, 81: 3-16.
66) Powell K. E. et Coll. Physical activity and health. Br. Med. J., 1996, 313: 126-7.
67) Kraemer W. J. et Coll. Hormonal and GH factor responses to heavy resistance exercise protocols, Journ. Appl. Physiol., 1990, 69: 1442-50.
68) Papadakis M. A. et Coll. GH replacement in healthy older men improves body composition but not functional ability. Ann. Intern. Med., 1996, 124: 708-16.
69) Blackman M. R. et Coll. GH and sex steroid administration in healthy aged women and men: a randomized controlled trial. JAMA, 2002, 288: 2282-92.
70) Christ E. R. et Coll. The importance of GH in the regulation of erythropoiesis, red cell mass, and plasma volume in adults with growth hormone deficiency, J. Clin. Endocrinol. Metab., 1997, 82: 2985-90.
71) Thuesen L. et Coll. Short and long term cardiovascular effects of GH therapy in GH deficient adults. Clin. Endocrinol. (Oxf.), 1994, 41: 615-20.
 daddydoctorgym.com il sito dove trovare alcuni consigli per il buon uso della palestra e la donazione di sangue
daddydoctorgym.com il sito dove trovare alcuni consigli per il buon uso della palestra e la donazione di sangue


Grazie Flavia, splendido lavoro, accurato ed esaustivo nella sua esposizione.
Sicuramente sarà molto apprezzato dai cultori della materia, ma anche da coloro che desiderano avere conoscenze tecniche ed appropriate su un argomento così attuale e di grande interesse.
Buon lavoro, con affetto, daddy.
Gentile Dottoressa Flavia,con la presente per chiederle,cortesemente, se la somministrazione di GH, induce anche la moltiplicazione delle cellule satelliti, la cui scomparsa innesca l’amiotrofia muscolare. E’ possibile,in Italia, trattare i malati di sla con il GH?
Buona sera Sig. Carlo Bruno, sono Stefano Graziani, alias daddydoctorgym. Le rispondo subito, ma non a nome
della Dr.ssa Flavia, almeno per ora, perchè un po’, ma solo un po’, mi sono informato al riguardo. Le dico che
al momento la letteratura sul suo interrogativo è ferma al 2006, senza novità più recenti. Accludo due link
da leggere che probabilmente già conosce.
Per un mio Amico di 30 anni con SLA ho fatto una ricerca con questo sua domanda ed altre, anche telefonica,
presso altri Colleghi esperti, a Natale 2011. Nessuna novità, purtroppo. L’eccellenza in Italia è all’Istituto
Besta di Milano e al Mondino di Pavia, per ricerca ed applicazioni cliniche affidabili ed efficaci, secondo i criteri della Medicina basata sull’evidenza (EBM). Spero di essere stato utile per inserire un piccolo tassello positivo alla sua ricerca. Nel frattempo ho già girato la sua mail alla Dr.ssa.
Auguri a chi ne ha bisogno, con affetto. Se vuole, a risentirci.
http://www.webalice.it/prati_50/aifa-sla.pdf
http://aisla.empowernet.it/news/entry.php?id=93
Ringrazio vivamente per la questione postami, senza dubbio spinosa!. Non mi sto più occupando da anni di queste tematiche, per cui posso rispondere in base alle mie limitate conoscenze pregresse.
Il GH sarebbe da escludere, in quanto per lo più lipolitico, mentre bisognerebbe concentrarsi sull’IGF-I, il quale possiede proprietà trofiche. Da qualche anno è stata isolata l’isoforma muscolare, l’IGF-Im, la quale pare venga iniettata direttamente nel muscolo implicato in modo che possa agire in modo rapido e specifico. Purtroppo non so se questi trattamenti vengano al momento sperimentati sui casi di SLA in America, giacché mi sto dedicando ad altro! In Italia, ovviamente, siamo al di fuori di tutto, anche per i costi attualmente troppo elevati!. Questo articolo forse può rendere un pò l’idea!.
Spero di essere stata in qualche modo utile e approfitto per mandare i miei più cordiali saluti!
Flavia
Grazie Flavia per la celere e qualificata risposta che subito giro sul blog, ai commenti sul tuo articolo, quale risposta al quesito del Sig. Carlo.
Un abrraccio e buon lavoro, ddg.
Il 22 gennaio ’13, il Sig. Carlo risponde:
Gentile signor Stefano Graziani, con la presente per ringraziarla dell’email che mi ha mandato. Le mie ricerche sul SOMATOTROPO sono finalizzate a ricercare se il GH sia un fattore di crescita neuronale
che agisca all’interno della barriera ematoencefalica. Felice mattinata.